Primeros organoides a partir de líquido amniótico de embarazos activos
Sin interferir con el feto ni la gestación, investigadores de Reino Unido han obtenido células epiteliales de origen pulmonar, renal y gastrointestinal de los fluidos amnióticos para desarrollar diversos miniórganos. El avance ayudará a conocer mejor las últimas etapas del embarazo y las alteraciones congénitas antes del nacimiento.
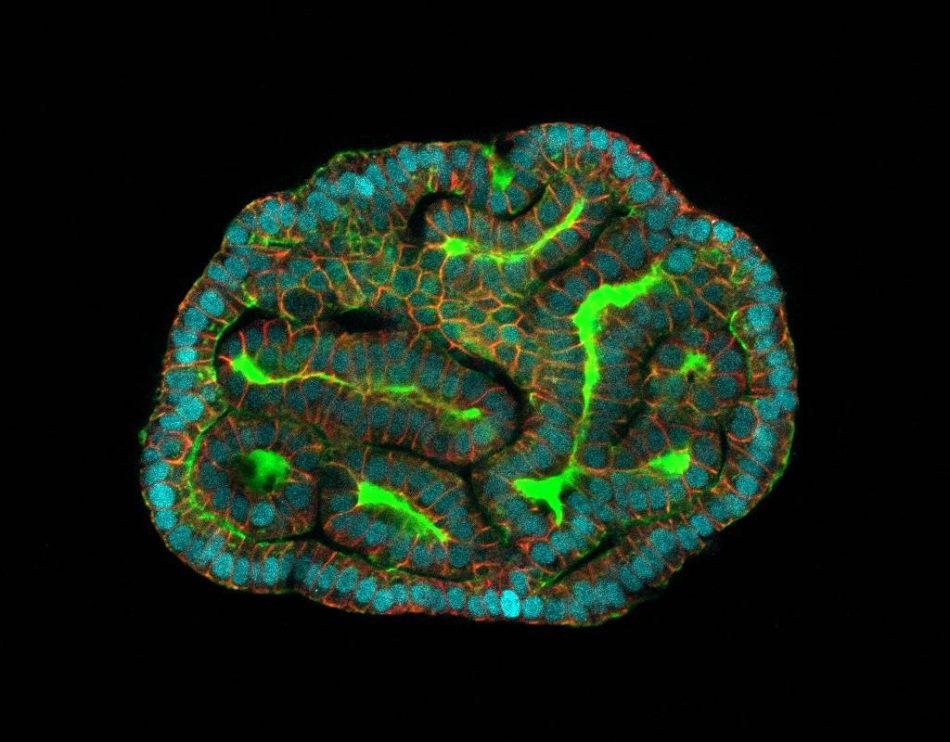
Los organoides son microtejidos en 3D derivados de células madre que recrean órganos humanos in vivo, como el pulmón, el hígado o el cerebro. Desde hace algunos años, se han convertido en valiosas herramientas para analizar el funcionamiento de estos, tanto cuando están sanos como cuando se ven afectados por una enfermedad.
Los métodos actuales de obtención de estas estructuras para modelizar el embarazo -en su mayoría a partir de tejido fetal post mortem– tienen implicaciones legales y éticas. Es más, por lo general solo están disponibles hasta las 20-22 semanas después de la concepción.
Este hecho ha restringido la investigación del desarrollo y de las alteraciones congénitas (las que afectan a cómo se forman las partes del cuerpo de un bebé o a su actividad) y ha resaltado la necesidad de nuevos modelos in vitro específicos para cada paciente.
Ahora, un estudio publicado en Nature Medicine revela que se pueden generar organoides de múltiples tipos de tejidos a partir de células recogidas de muestras de líquido amniótico sin necesidad de interrumpir el embarazo, lo que optimizaría la comprensión de las últimas fases de la gestación y el tratamiento de estas anomalías congénitas.
El trabajo, liderado por científicos del University College de Londres (Reino Unido), plantea la hipótesis de que sería posible cultivar estos modelos celulares complejos a partir de células madre que hubieran pasado al líquido amniótico, que rodea al feto en el útero y lo protege mientras crece durante el embarazo.
“Es la primera vez que se cultivan organoides a partir de células madre humanas durante un embarazo activo. Como no se tocaría a la criatura durante el proceso de extracción, se superarían las restricciones de muestreo y estos miniórganos también conservarían la información biológica del bebé”, explica a SINC Paolo De Coppi, coautor principal de la investigación.
“Las malformaciones congénitas se diagnostican mediante una combinación de pruebas que incluyen la imagen (ecografía y resonancia magnética) y la genética”, añade De Coppi, “así, los organoides ofrecen la posibilidad de realizar una prueba funcional adicional”.
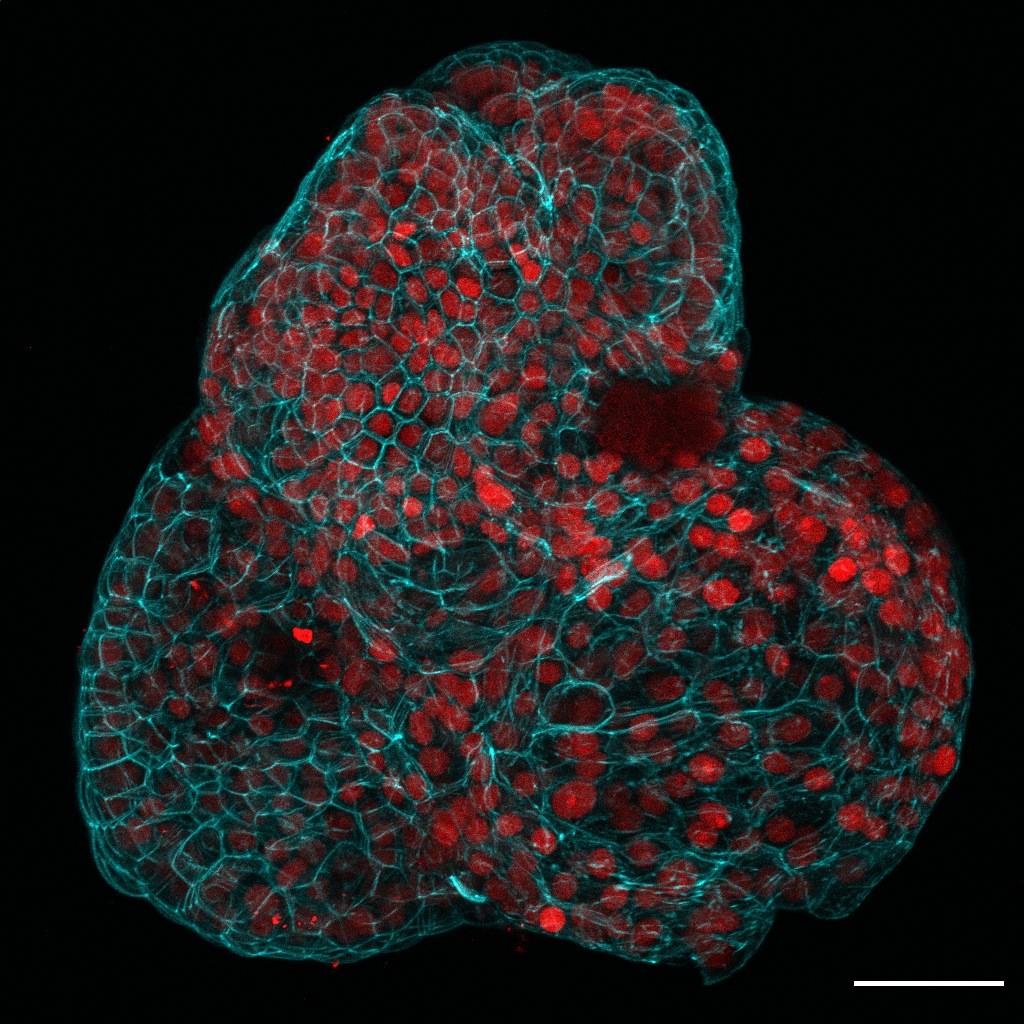
Impulso a la medicina prenatal
En este estudio, los investigadores extrajeron y caracterizaron células vivas de muestras de líquido amniótico tomadas de 12 embarazos dentro de la batería de pruebas diagnósticas rutinarias como la amniocentesis.
A continuación, utilizaron la secuenciación unicelular del ARN para identificar de qué tejidos procedían estas células madre. De esta forma aislaron células epiteliales de origen pulmonar, renal y gastrointestinal, que se utilizaron para cultivar organoides con características funcionales del pulmón, riñón e intestino respectivamente.
“Los organoides que creamos a partir de células de líquido amniótico poseen muchas de las funciones de los tejidos que representan, incluida la expresión de genes y proteínas”, afirma Mattia Gerli, primer autor del estudio.
“Permitirán estudiar lo que ocurre durante el desarrollo –continúa–, algo que hasta ahora no había sido posible. Sabemos muy poco sobre la última etapa del embarazo humano, por lo que es increíblemente emocionante abrir nuevas áreas de la medicina prenatal”.
Estudio en una malformación congénita
Con el objetivo de evaluar cómo podrían utilizarse los organoides en el tratamiento de enfermedades congénitas, el equipo colaboró con expertos de la Universidad Católica de Lovaina (Bélgica) para analizar el desarrollo de bebés con hernia diafragmática congénita (HDC), una enfermedad en la que un orificio en el diafragma hace que órganos como el intestino y el hígado se desplacen hacia el tórax, ejerciendo presión sobre los pulmones e impidiendo un crecimiento sano.
Los organoides de bebés con HDC se compararon con los de otros sanos para estudiar las características biológicas de cada grupo. Como era de esperar, hubo diferencias significativas en el desarrollo entre los miniórganos antes y después del tratamiento. Sin embargo, aquellos con la anomalía postratamiento eran mucho más parecidos a los sanos, lo que proporciona una estimación de la eficacia del tratamiento a nivel celular.
“Podemos hacer por primera vez una evaluación funcional de la afección congénita de un niño antes de nacer, lo que supone un gran paso adelante para la medicina prenatal. Normalmente, el diagnóstico se basa en pruebas de imagen como la ecografía o la resonancia magnética y en análisis genéticos”, apunta De Coppi.
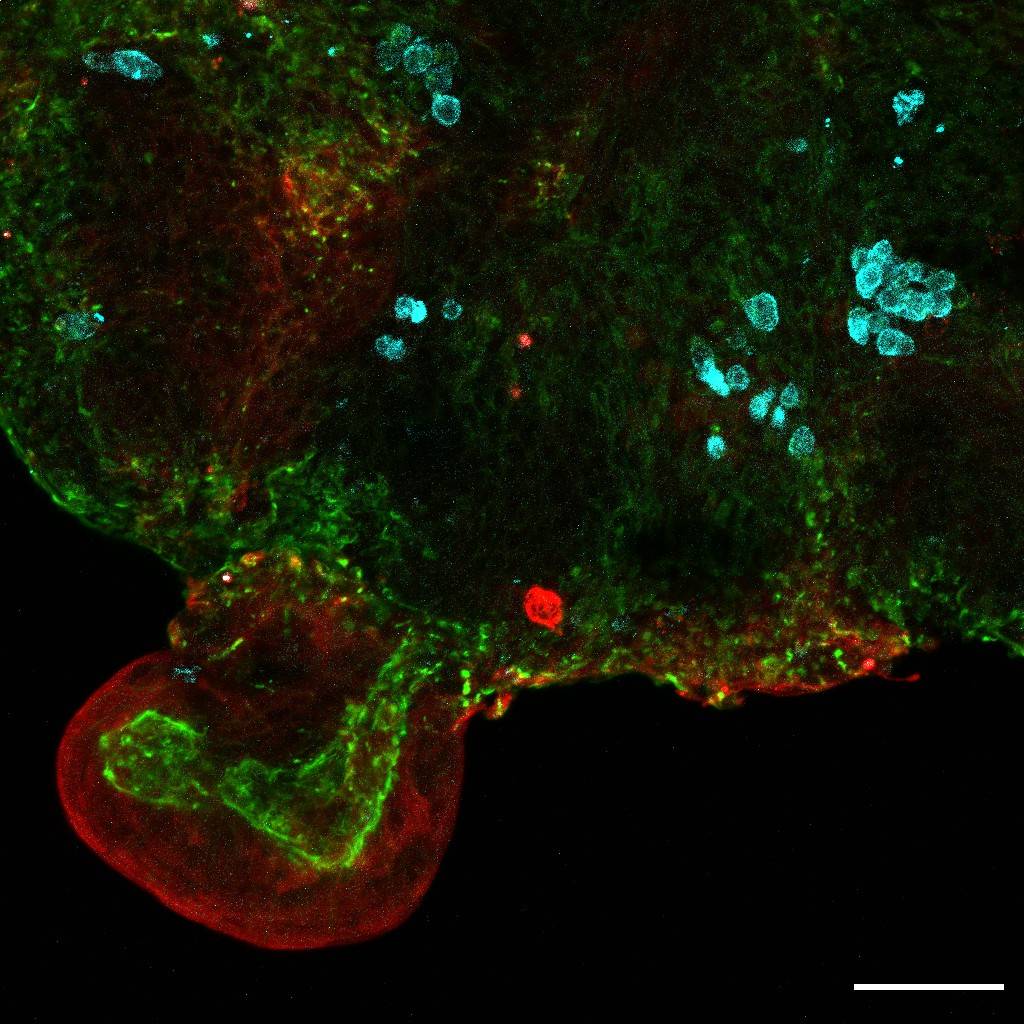
Limitaciones del trabajo
Los científicos puntualizan que sus hallazgos pueden ofrecer la oportunidad de derivar organoides fetales primarios de forma autóloga [es decir, se obtienen del mismo individuo que lo recibe] durante embarazos en curso, lo que podría permitir el desarrollo de modelos prenatales avanzados y terapias personalizadas y optimizar el asesoramiento a los padres y madres.
“Cuando nos reunimos con familias con un diagnóstico prenatal, a menudo no podemos decirles mucho sobre el resultado porque cada caso es diferente. No pretendemos hacerlo todavía, pero la capacidad de estudiar organoides prenatales funcionales es el primer paso para ofrecer un pronóstico más detallado y, con suerte, proporcionar tratamientos más eficaces en el futuro”, aclara De Coppi.
De hecho, señalan que se necesitan más estudios para validar el impacto traslacional de estos hallazgos. “Algunas de las limitaciones son que los organoides derivados del líquido amniótico aún no están listos para la clínica y no pueden utilizarse en esta fase para tratar enfermedades”, detalla a SINC Gerli.
“Además, solo se puede modelizar el compartimento epitelial de unos pocos tejidos: pulmón, riñón e intestino. Y por ahora no son una alternativa a los organoides derivados de células madre pluripotentes, y no sustituyen la obtención de células y organoides a partir de tejidos terminados”, concluye el investigador del University College de Londres.
Referencia:
Mattia Gerli et al. “Single-cell guided prenatal derivation of primary fetal epithelial organoids from human amniotic and tracheal fluids”. Nature Medicine 2024
Fuente: SINC


